什么是同位素(同位素的关键是中子变异)
什么是同位素(同位素的关键是中子变异)原子是物质的基础 .任何具有质量并占据空间的东西都是由这些微小单元组成.这与呼吸的空气,饮用的水和我们身体本身息息相关.

同位素是原子研究中的重要概念.化学家,物理学家和地质学家使用它们来理解我们的世界. 但是在我们解释什么是同位素或它们为什么如此重要之前,我们需要退后一步,并从整体上看待原子.
原子世界您可能知道,原子有三个主要成分,其中两个位于原子核中.原子核位于原子的中心,是一个紧密堆积的粒子簇.其中一些粒子是质子,它们具有正电荷.
有充分文件证明,带相反电荷的物质会相互吸引.同时,带相同电荷的物体倾向于相互排斥.所以这是一个问题:两个或多个带有正电荷的质子如何在同一个原子核中共存? 它们不应该互相排斥吗?.
这时候中子出现了.中子是亚原子粒子,与质子共享核.但是中子没有电荷.正如其名,中子是中性的,既不带正电荷,也不带负电荷.这是一个重要属性.由于其中性,中子可以阻止质子将另一个质子从原子核中挤出来.

围绕原子核运行的是电子,具有负电荷的超轻粒子.电子促进化学结合,它们的运动可以产生一种叫做电的小东西.质子同样重要,首先,它们帮助科学家区分这些元素.
同位素您可能已经注意到,在大多数版本周期表中,每个方块的右上角都印有一个小数字.该数字称为原子序数.它告诉读者给定元素的原子核中有多少质子.例如,氧的原子序数是8.宇宙中每个氧原子都有一个原子核,不多不少,只有八个质子.

没有这种非常具体的粒子排列,氧原子就不会是氧原子.每个元素的原子序数都是独一无二的.这是一个决定性的特征,没有其他元素每个原子核有八个质子.通过计算质子,你可以识别一个原子.正如氧原子总是有八个质子一样,氮原子也总是带有七个质子,就这么简单
中子不跟风.氧原子中的原子核只有八个质子(正如我们已经确定的那样).然而,它也可能包含4到20个中子.同位素是同一化学元素的变体,具有不同数量的中子.

现在,每个同位素都是根据其质量数命名的,即一个原子中中子和质子的总数量.例如,一大家都知道的氧同位素叫做氧-18(O-18),它有标准的8个质子加10个中子.
因此,氧-18(O-18)的质量数是18,您猜对了.一种相关的同位素氧-17(O-17),原子核中的中子少一个.
不稳定一些原子组合比其他组合更强大.科学家将O-17和O-18归类为稳定同位素.在稳定的同位素中,质子和中子施加的力相互保持在一起,永久保持原子核完好无损.
另一方面,放射性同位素中的核是不稳定的,并且会随着时间的流逝而衰减.长远来看,这些同位素的质子与中子之比根本不可持续.没有东西愿意留在这种不稳定的困境中.因此,放射性同位素将脱落某些亚原子粒子(并释放能量),直到它们自身转化为稳定的同位素为止.
氧-18稳定,但氧-19(O-19)不稳定.后者将不可避免地快速崩溃!在创建后的26.88秒内,可以确保O-19的样本会因衰变而损失一半的原子.
这意味着氧-19的半衰期为26.88秒.半衰期是指同位素样品的50%衰减所需的时间.记住这个概念;我们将在下文中将其与古生物学联系起来.

但是,在我们谈论古化石科学之前,有一个很重要的问题需要提出来.与氧不同,某些元素根本没有任何稳定的同位素.如铀,在自然界中,这种重金属存在三种同位素,它们都具有放射性,原子核处于恒定的衰变状态.最终,大块铀将变成完全不同的元素.
不要为实时观看过渡而烦恼,这个过程进展得非常非常缓慢.
获取时间铀-238(U-238)是元素中最常见的同位素,其半衰期约为45亿年!它将逐渐变为稳定的铅-206(Pb-206).同样,铀235(U-235)(具有7.04亿年的半衰期)会过渡到另一种稳定同位素铅-207(Pb-207).

对于地质学家来说,这确实是有用的信息.假设有人发现一块岩石,其锆石晶体包含U-235和Pb-207的混合物.这两个原子的比例可以帮助科学家确定岩石的年龄.
方法如下:假设铅原子远远超过其铀对应原子.在这种情况下,您寻找到这一块岩石就很古老.毕竟,铀有充裕的时间开始将自身转化为铅.另一方面,如果事实正好相反,而铀原子更常见,那么岩石必须处于较年轻的一侧.
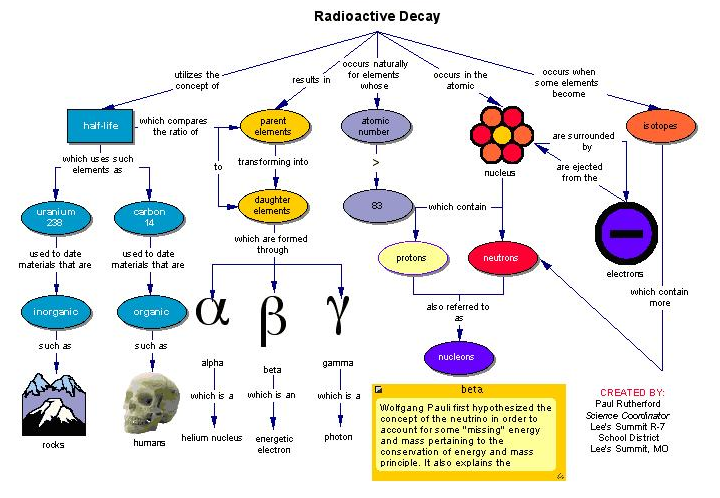
我刚刚描述的技术称为辐射测年法.这就是使用有据可查的不稳定同位素的衰减率,来估算岩石样品和地质构造年龄的行为.古生物学家利用这一方法,来确定自某种化石沉积以来已经过去了多少时间.
您无需成为史前文明爱好者也可以欣赏同位素.医生使用一些放射性元素来监测血液流动,研究骨骼生长,甚至对抗癌症.放射性同位素也已用于土质检测.
中子变异性,看似抽象,却影响着从癌症治疗到更深层奥秘的所有事物.科学真棒.








